作品描述:
分享自己研一以来做 WB 的结果和总结的一些经验
WB 的成长作为研一的萌新,WB 可是每周都会进行1-2 次的,但这个基础的实验也是让我极为头疼的实验,可称为“玄学”。以下将我这近一年的WB结果和经验分享出来,诸位献丑了。
1. 内参
WB 结果可靠不可靠,关键看内参。刚入学,WB 内参的结果是这样的
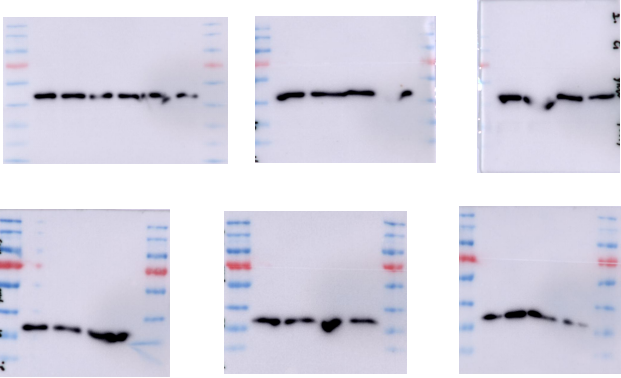
分析原因和解决方案:
(1) 配制的胶不合格。配制胶时用的仪器、试剂要干净无杂质;加入各种实际时要充分混匀,尤其最后的TEMED,要混匀胶,贴玻璃边角加入;凝固时避免碰撞、移动等。
(2) 电泳温度高,使胶变形。在电泳时可以减小电压或者用冰袋进行降温。
(3) 电泳电流不均一。换电泳槽,最好不要用最两边的孔。
(4) 内参选择不正确。参考文献选用合适的内参,对实验有影响的内参不可选用。
调整操作后,内参好看了一些,但有时还会不齐,这时候就要重新定量或者根据内参调整上样量了。
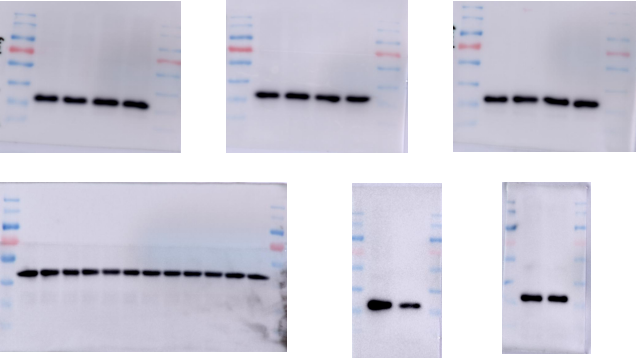
2. 目的
目的条带可是自己准备好几天的结果,也是问题出现最多的
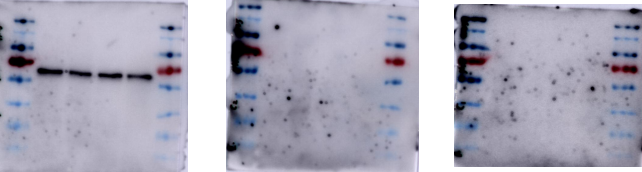
(1) 膜上出现黑斑黑点。
原因分析与解决办法:
1) 封闭液未完全溶解。在配制封闭液时,要充分混匀,确保封闭粉完全溶解。
2) 洗涤不充分。在敷一抗前要充分洗涤去除封闭液;洗涤控制时间,未结合的杂质要清洗干净。

(2) 目标条带无信号
原因分析与解决办法:
1) 蛋白降解。蛋白在收取中要注意在冰上操作;提取或者保存时添加蛋白抑制剂;避免反复冻融。
2) 表达量过低。可以根据内参判断是否为蛋白问题;增加上样蛋白量;增加曝光时间。
3) 转膜错误。可根据内参来判断是否为转膜原因;选取适合目的分子量的转膜电压和时间;三明治结构未放反;选择合适的PVDF膜。4) 抗体错误。一抗特异性差,可根据文献选择合适公司的抗体;根据试剂商提供的说明书稀释抗体和使用抗体次数;二抗看清是兔抗还是鼠抗。
5) 洗膜过度。选择合适的洗膜时间。6) 曝光液失效。重新配置曝光液。
(3) 条带中有气泡
原因分析与解决办法:
1) 转膜失败。在转膜时要充分排干气泡;滤纸、海绵要铺平;转膜时注意降温,可在冰箱中电转。
2) 配胶不合格。见前。
3) 曝光错误。膜与曝光底板紧密贴合,无气泡;曝光液滴加均匀。
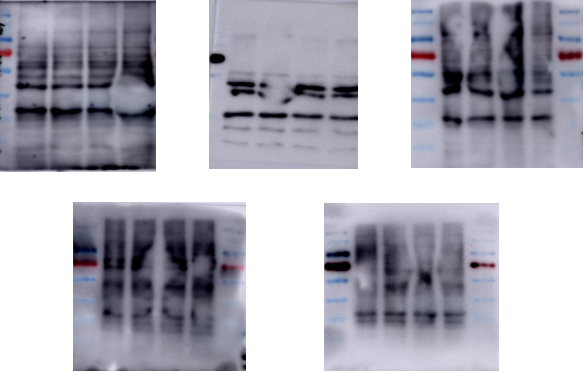
(4) 杂带过多
原因分析与解决办法:
1) 抗体特异性差。见前。
2) 磷酸化蛋白。
3) 封闭不彻底。选择合适的封闭液、封闭时间及封闭液浓度。
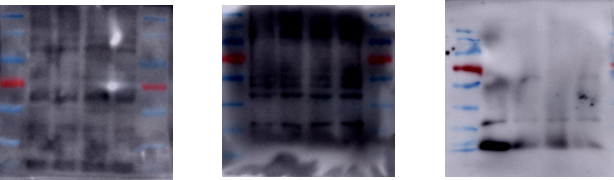
(5) 图片背景太深
原因分析及解决办法:
1) 洗膜不充分。见前
2) 抗体浓度过高。
3) 封闭时间或浓度不当。
4) 曝光液失效或配制比例错误。
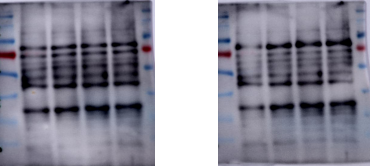
(6) 哑铃型条带
原因分析及解决方法:
1) 胶配制不合格。见前。
2) 样本中有杂质。收取蛋白时注意周围环境,避免杂质进入;使用样品前离心。
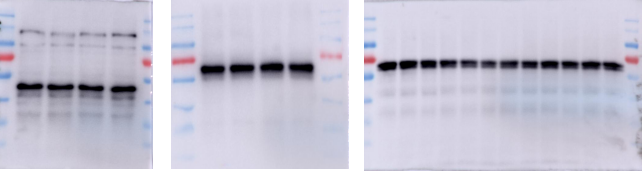
现在,可以跑出一些好看的条带,但重要的是要有期望的趋势,这又考虑很多的因素,只能慢慢控制好每一步,重复实验啦。
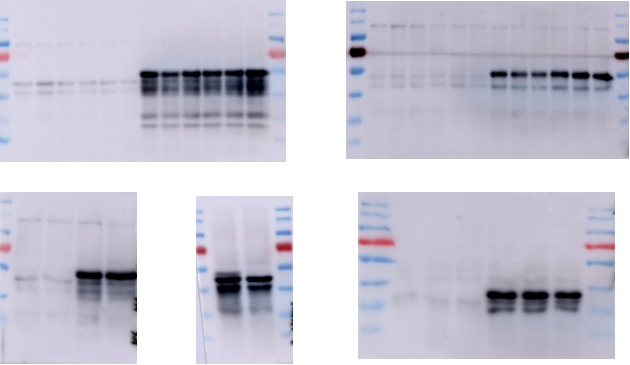
以上就是我的 WB 成长之路,也是我这一年来的成长,与诸位共勉。
Bio-Rad官方评论 :你的经验太棒了,不送你上墙就是我的错了,😄







