Improve Health
近日,中国医学科学院肿瘤医院寿建忠教授团队建立并验证了转移性 PRCC-TFE3 融合异位性肾细胞癌(tRCC)患者的类器官(Organoids),并首次实现了高通量筛选(High-throughput screening,HTS)过程,希望通过 HTS 寻找潜在治疗药物,并通过 RNA-seq 和细胞研究探索其可能的机制。
相关成果「Phenotypical screening on metastatic PRCC‐TFE3 fusion translocation renal cell carcinoma organoids reveals potential therapeutic agents」发表于「Clinical and Translational Oncology」。中国医学科学院肿瘤医院曹传振博士为本研究的第一作者。领星完成 RNA-seq 测序与分析部分。

MiT 家族异位性肾细胞癌(tRCC)是一种主要发生在儿童和青少年中的肾细胞癌亚型,仅占成人肾细胞癌(RCCs)的 1.3%-1.5%,目前仍未有有效的治疗方式。位于 Xp11.2 的基因 TFE3 融合是 tRCC 独特的特征,常见的融合类型有:PRCC-TFE3,ASPL-TFE3 与 PFS-TFE3。
本研究通过建立并利用患者肿瘤组织来源的类器官,进行高通量筛选(HTS),以期探究转移性 PRCC-TFE3 融合的 tRCC 患者潜在的治疗药物,并通过 RNA-seq 和细胞研究探索其可能的机制。
主要研究方法:
收集未经治疗的转移性 tRCC(组织病理学与 FISH 验证)患者的肿瘤组织,进行类器官的体外培养,并通过 FISH 和 RNA-seq 进行验证。此外,通过 HTS 寻找潜在药物,通过 RNA-seq 与细胞研究探索其可能的机制。

▲ 图 1: 从组织获得到化合物筛选的整个过程
主要结果描述:
(1)本研究成功建立了转移性 PRCC-TFE3 融合的 tRCC 类器官,并通过组织病理学,FISH 与 RNA-seq 验证了其特征。在该类器官模型中,原发性肿瘤的组织结构,表型,细胞组成和典型的 PRCC-TFE3 基因融合是可靠并保守的。

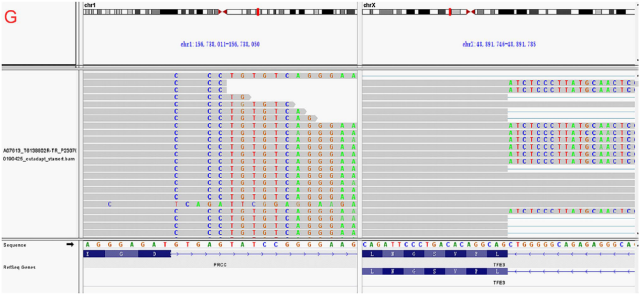
▲图 2(A-G): PRCC-TFE3 基因融合类器官的特征描述(组织病理学,FISH 与 RNA-seq)
(2)描述了高通量筛选(HTS)方法,共筛选了 1816 种药物的化合物库,最终对阿西替尼、克唑替尼与 JQ-1 这三种药物进行进一步验证,发现其可诱导细胞周期阻滞与凋亡,而治疗后类器官的 RNA-seq 分析表明,克唑替尼诱导了自噬相关基因的显著改变,这与 tRCC 的潜在发病机制是一致的。
结论:
本研究成功建立并验证了转移性 PRCC-TFE3 基因融合的 tRCC 类器官,并首次实现了 HTS 过程。克唑替尼可能是一种值得临床探索的靶向治疗转移性 PRCC-TFE3 基因融合的 tRCC 的方法。
图片来源:领星
Improve Health