感谢由天津环湖医院 MDT 团队提供的精彩案例
MDT 成员

放疗科 王政
医学硕士,天津市环湖医院肿瘤放射治疗科副主任医师。神经系统肿瘤放化疗经验丰富,并发表过多篇 SCI 文章。

神经外科 王焕宇
医学博士,副主任医师,毕业于天津医科大学,临床经验丰富,参与完成各种神经肿瘤手术 3000 余台。擅长胶质瘤的综合治疗,脑膜瘤、垂体瘤的手术治疗,神经鞘瘤的手术治疗。尤其善于将微创治疗的理念应用于神经肿瘤的手术治疗中。

病理科 张学斌
天津市环湖医院病理科副主任医师,天津市医学会病理分会青年委员。2009 年毕业于天津医科大学临床医学(本科硕士连续培养)专业。擅长神经系统疾病的病理诊断,尤其是脑肿瘤的病理诊断、分子诊断和相关基础研究,同时对神经肌肉病理诊断有一定认识。
· 病例陈述 ·
患者是 51 岁女性,主诉间断头痛 1 月,加重 1 天。神经系统查体未见明显阳性体征,头部 CT 平扫检查显示,颅内多发占位性病灶(左侧丘脑,左侧额叶),左侧侧脑室额角轻度受压(图 1)。
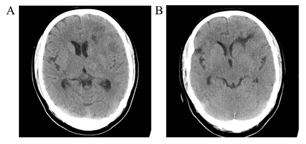
图 1 头部影像学检查(CT 平扫)
头部磁共振成像(MRI)检查显示,左额、双侧丘脑、右侧大脑脚占位性病变,FLAIR 加权像上呈略高信号,T1 加权像上呈低信号;静注 GD-DTPA 后左额及左侧丘脑病灶呈明显强化改变,增强信号欠均匀,边界尚清晰,其中左额病灶最大尺寸为 4.5 cm×4.1 cm×4.0 cm(图 2)。
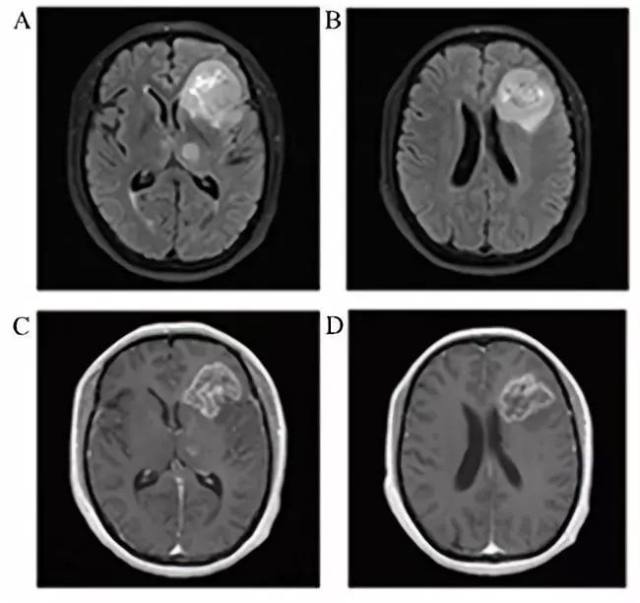
图 2 头部影像学检查(MRI)
患者无已知的过敏史,不吸烟、不饮酒,不使用违禁物质且直系亲属无癌症病史。进一步的胸 CT(平扫)、超声(肝胆胰脾、双肾)等检查未见明显异常。
鉴别诊断:
结合患者临床特征及相关影像学检查结果考虑是颅内多发占位胶质瘤的可能性大,综合考虑手术风险及重要神经功能损伤因素后,决定切除较大的左额病灶,同时明确病理诊断。
入院后 3 天完善术前相关检查后,患者接受了开颅探查左额病灶切除术,术中冰冻病理回报高级别胶质瘤,进一步肉眼全切左额病灶。术后 24 小时 CT 平扫检查显示,左额病灶切除范围较满意(图 3A-B)。

图 3 开颅探查左额病灶切除术后 24 h 影像学检查(CT 平扫)
病理诊断:
HE 染色显示肿瘤细胞弥漫性分布,细胞核呈圆形或卵圆形,异型性明显,染色质浓集深染,核分裂易见。可见血管内皮细胞增生及小灶性出血、坏死。免疫组化染色结果显示:H3K27M 部分阳性(图 4B)H3K27Me3 阴性(图 4C)。
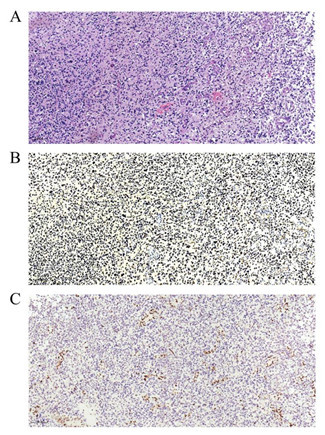
图 4 A:肿瘤细胞的 HE 染色;B-C:免疫组化染色
整合诊断:弥漫中线胶质瘤 H3K27M 突变(WHOIV 级)。
病理讨论:
2016 年世界卫生组织(WHO)中枢神经系统肿瘤分类将弥漫中线胶质瘤,H3 K27M-突变定义为弥漫性浸润性中线的高级别胶质瘤,以星形胶质瘤细胞分化和组蛋白 H3 基因 H3F3A 或更少见的 HIST1 H3B K27M-突变为主要特征。脑干、丘脑和脊髓是其常见好发部位,通常预后不良。好发于儿童,成人相对少见。2018 年 Bette 等人发表文章指出伴有 H3K27M 突变的成人弥漫中线胶质瘤预后与儿童患者相似,OS 仅为 9.3 个月[1]。
· 治疗方案 ·
该患者最终诊断为弥漫中线胶质瘤,H3K27M 突变(WHO IV 级),考虑该病理类型预后差,同时该患者仅切除了左额病灶,而双侧丘脑病灶未予手术干预。因此,为了最大限度的控制肿瘤生长,故在 MDT 讨论后对患者采用了 START 方案(替莫唑胺超早期化疗)[2]。
化疗后患者逐渐出现右侧肢体麻木症状,未予特殊处理,化疗后 3 周复查头部磁共振成像(MRI)检查,FLAIR 平扫(图 5A-B)及 T1 增强序列图 5START 方案-超早期化疗后 3 周头部影像学检查(MRI)(图 5C-D)均显示左侧丘脑部位肿瘤体积较治疗前明显增大,考虑是左侧丘脑部位肿瘤进展。
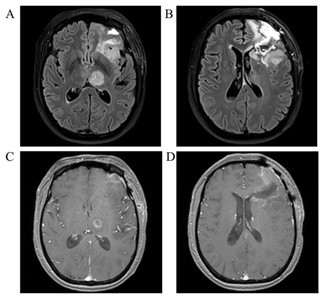
图 5 START 方案-超早期化疗后 3 周头部影像学检查(MRI)
多学科会诊(MDT):
综合影像科、神经外科以及放疗科的讨论结果如下:
(1)目前患者左侧丘脑病灶在替莫唑胺超早期化疗后出现了明显进展,与患者右侧肢体麻木症状相吻合;
(2)考虑手术可能造成的神经功能损伤等因素,暂时不考虑切除左侧丘脑病灶;
(3)患者既往无放射治疗史,目前术后 4 周,故根据 NCCN 指南推荐可针对双侧丘脑未切除病灶以及左额手术区域予以放射治疗,为了最大限度的保护靶区外的危险器官,故首选调强放射治疗技术实施放疗;
(4)目前患者的替莫唑胺 START 方案-超早期化疗无明显获益,同时患者左额病变组织未检测出 MGMT 启动子甲基化,故暂不考虑替莫唑胺治疗;
(5)节律性化疗(metronomic chemotherapy)是紧密的、规律的予以患者相对低剂量的细胞毒类药物的一种化疗策略,由于节律化疗抗肿瘤机制不仅对增殖的肿瘤细胞产生细胞毒作用,同时还兼具抗血管生成以及免疫增强作用[3–4],因此理论上适合治疗具备高度血管生成特征的胶质母细胞瘤,结合本科经验考虑应用 VP-16 节律化疗方案行同步放化疗;
(6)针对左额病变标本应用全外显子(CWES)检测,协助明确生物学特性,探索新疗法。
辅助放射治疗:
患者随后接受了 40 Gy/20f 的调强放射治疗,见剂量分布(图 6A)及 DVH 图(图 6B),期间同步 VP-1650 mgQd 节律化疗。

图 6 40 Gy/20f 的调强放射治疗的剂量分布和 DVH 图
累积剂量 40 Gy/20f 后复查头核磁共振(平扫+增强),显示颅内原有病灶控制稳定,左侧丘脑病灶 FLAIR(图 7A)及 T1 增强影像(图 7B)均未见增长。
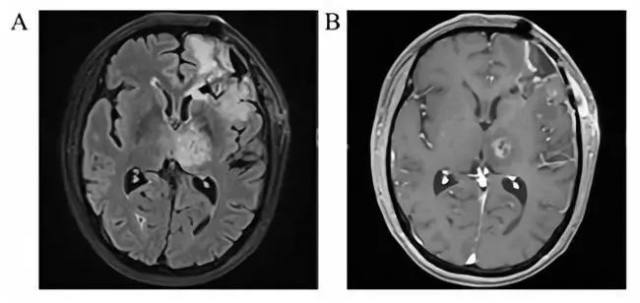
图 7 累积剂量 40 Gy/20f 后头部影像学检查(MRI, 平扫+增强)
结合本科既往治疗经验[5],在 40 Gy/20f 的剂量基础上,针对左侧丘脑病灶 T1 强化区域予以同期推量调强放射治疗(simultaneous integrate boost with intensity-modulated radiotherapy,SIB-IMRT)23 Gy/10f,同时 FLAIR 所示异常区域予以 18 GY/10f 同期照射,相应剂量分布及 DVH 图分别见图 8A 及 8B。
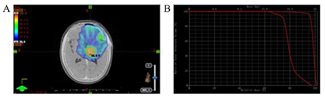
图 8 同期推量调强放射治疗剂量分布和 DVH 图
全外显子(CWES)检测结果解读:
结果显示患者伴有多个驱动基因的突变以及染色体异常(图 9):
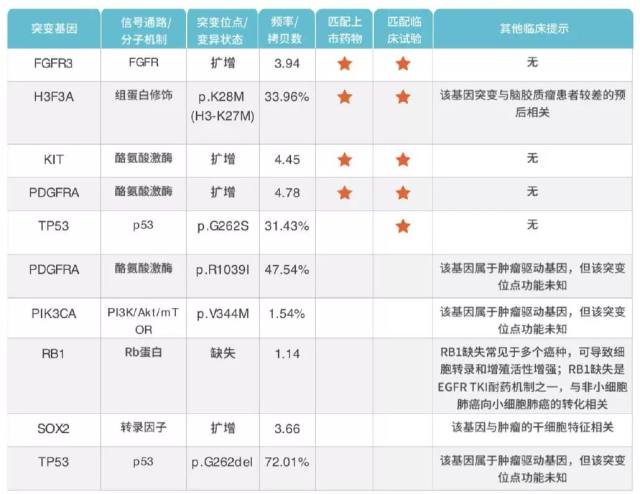
图 9 左额病变标本的全外显子检测
(1)H3F3A p.K28M 突变,符合免疫组化结果,支持弥漫中线胶质瘤 H3K27M 突变的诊断。
(2)患者 TMB 63(4.09/MB)相应免疫治疗预期 ORR 为 14.5%,因此考虑免疫检查点抑制剂治疗获益不明显。
(3)FGFR3、PDGFRA、KIT 扩增同时伴有 PDGFRA 突变,因此考虑应用多靶点 TKI 药物陪唑帕尼(Pazopanib)联合治疗[6]。
· 治疗效果 ·
放疗后 1 个月复查头核磁共振(平扫+增强),FLAIR 影像可见颅内原有异常信号范围均明显缩小(图 10A),T1 增强影像显示左侧丘脑病变区域异常强化信号明显缩小,占位效应减轻(图 10B)。此时患者一般状况较好,右侧肢体麻木症状基本缓解,KPS 评分 100,继续接受 VP-16 节律化疗同时服用陪唑帕尼协同治疗。
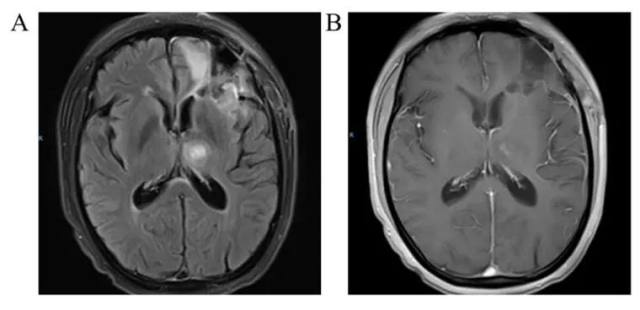
图 10 辅助放射治疗后 1 个月头部影像学检查(MRI, 平扫+增强)
放疗后 3 个月复查头核磁共振(平扫+增强),FLAIR 影像可见颅内原有异常信号范围进一步缩小(图 11A),T1 增强影像显示左侧丘脑病变区域原有异常强化信号几乎消失(图 11B)。
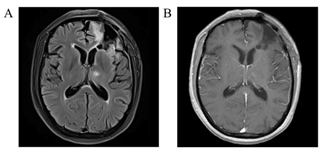
图 11 辅助放射治疗后 3 个月头部影像学检查(MRI, 平扫+增强)
此时患者无任何神经系统症状,无需应用激素治疗,根据 RANO 标准考虑肿瘤完全缓解(CR)。
患者自发病至今整个治疗过程时间轴见图 12。
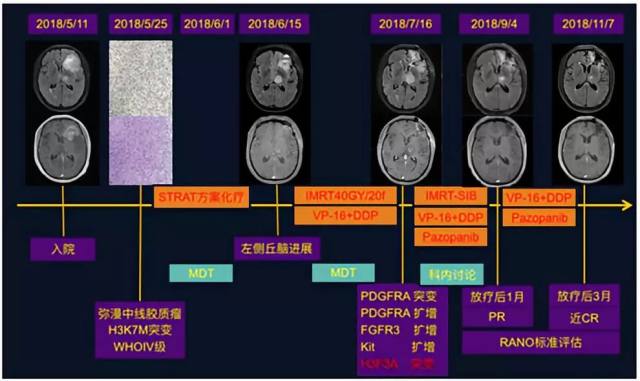
图 12 患者自发病至今的整个治疗过程时间轴
· 总结 ·
·成人弥漫中线胶质瘤 H3K 27M 突变(WHO IV)级预后差;
·替莫唑胺超早期化疗无明显获益且不伴 MGMT 启动子甲基化的患者可考虑 VP-16 节律化疗;
·根据 CWES 检测结果完善个体化综合治疗方案;
·对于明显局限性强化病灶的区域采用 SIB-IMRT 技术有助于协同提高肿瘤局部控制率;
·推荐胶质瘤患者采用 RNAO 标准评估疗效;
·多学科会诊(MDT)是真实世界中神经系统肿瘤精准治疗的必经之路。
参考文献:
[1] Kleinschmidt DeMasters BK, Mulcahy Levy JM. H3 K27M mutantgliomas in adults vs. children share similar histological features and adverse prognosis[J]. Clinical Neuropathologys, 2018, 37(2018)(2): 3 – 63.
[2] Mao Y, Yao Y, Zhang Li, et al. Does Early Postsurgical Temozolomide Plus Concomitant Radiochemotherapy Regimen Have Any Benefit in Newly-diagnosed Glioblastoma Patients? A Multi-center, Randomized, Parallel, Open-label, Phase II Clinical Trial[J]. Chinese Medical Journal(English), 2015, 128(20): 2751 – 2758.
[3] Kerbel RS, Kamen BA. The antiangiogenic basis of metronomic chemotherapy[J]. Nature Reviews Cancer, 2004, 4(6): 423 – 436.
[4] Lutsiak ME, Semnani RT, De Pascalis R, et al. Inhibition of CD4(+)25+ T regulatory cell function implicated in enhanced immune response by low dose cyclophosphamide[J]. Blood, 2005, 05(7): 2862 – 2868.
[5] 王政, 姜炜, 庞青松, 等. 胶质母细胞瘤同期推量 IMRT 安全性分析 [J]. 中华放射肿瘤学杂志, 2015, 24(4): 431–433.
[6] Iwamoto FM, Lamborn KR, Robins HI, et al. Phase II trial of pazopanib (GW786034), an oral multitargeted angiogenesis inhibitor, for adults with recurrent glioblastoma (North American Brain Tumor Consortium Study 06-02)[J]. Neuro-oncology, 2010, 12(8): 855 – 61.
关于领星

