无论是出于科研还是工业目的,成功的表达并且纯化所需的蛋白,都是进一步进行分析和研究的基础。在质上和量上有所不同,选择一个合适的纯化系统,来生产并纯化所需质和量的蛋白,值得慎重的考虑。一套合适的纯化系统,不仅可以节省时间和成本,更可以节省蛋白样品。
亲和层析法
将目的蛋白从其他细胞组分中纯化出来的方法多种多样。目前,最常用的方法之一是亲和层析法。
在其中,通常的方法是将目的蛋白与一段特殊的短肽或蛋白,也就是亲和标签所融合。这种亲和标签针对配体有特殊的亲和力。而配体可以是固定在层析基质上的其他蛋白质,小分子或是金属。当融合有亲和标签的蛋白通过标签-配体作用结合再层析基质上时,通过洗杂步骤,即可去除掉其他的细胞成分。
为了洗脱所需要的蛋白质,通过改变缓冲液的条件,如 pH 或通过竞争亲和标签和配体连接的方法来进行。

但怎样的纯化是较为成功的呢?仅达到所需的质量量级,如毫克级(或克级)即可满足吗?
这些并不简单。质在蛋白纯化中同样尤为重要,比如,就蛋白的生物活性和纯度而言,通常会有所要求。
以下我们来讨论并且比较 2 种技术:
His-tag 系统和 Strep-tag® 系统,都使用了亲和层析法来纯化得到所需的蛋白质,为目前所常用的技术方法。
His-tag 系统有很高的蛋白产量 (5–40 mg/ml resin),但理想情况下的纯度约为 80% 左右。但如需在随后的分析中测量蛋白质的功能,就需要再进行更多的 cleaning steps。
Strep-tag® 系统一步纯化满足的纯度可达到 95%,无需进行更多的纯化步骤即可直接进行蛋白的分析。产量数据为 16 mg/ml。
深度对比 Strep-tag® 与 His-tag 系统
His-tag 是以 6 个组氨酸残基组合的融合标签,其基于蛋白质表面的组氨酸残基侧链,在中性和弱碱性条件下可以和固定化的金属离子相互作用 (如 Ni 离子,Zn 离子,Co 离子等),从而达到纯化蛋白的目的。此系统的洗脱方式可以用过三种非特异性步骤达成:
- 降低 pH(4.5-6)
- 加入 EDTA
- 不同浓度咪唑溶液(20-250 mM)
当蛋白洗脱完毕后,使用 EDTA 使纯化树脂与金属离子分离,即可完成树脂的再生。
Strep-tag® 则是基于链霉亲和素 (Streptavidin)和生物素这一自然的相互作用,将 Strep-tag® II(WSHPQFEK)或 Twin-Strep-tag® 作为亲和标签(后者包含 2 个 Strep-tag® II,中间加入 spacer 间隔开来)。这两种标签都可与改造后的链霉亲和素 (Streptavidin) 上的生物素结合位点相结合,通过使用脱硫生物素或生物素,即可将 Strep-tag® 标签蛋白洗脱下来。
由于 His-tag 系统具有吸附量大,性价比高,和可以在变性条件下进行蛋白纯化等优点,使其为大众所熟知。而 Strep-tag® 系统则可以获得高纯度的蛋白,但其同时也可以耐受多种缓冲液的使用。下面让我们对二者进行各项数据进行比较:
耐受的纯化条件
下表为 His-tag 与 Strep-tag® 系统的耐受缓冲液对比
|
reagents |
|
His-tag system |
Strep-tag® technology |
|
reducing agents |
DTT |
not recommended |
50 mM |
|
|
β-mercaptoethanol |
up to 20 mM |
50 mM |
|
|
TCEP |
not recommended |
10 mM |
|
denaturing agents |
urea |
8 M |
6 M |
|
|
guanidine |
6 M |
1 M |
|
detergents |
Triton X-100 |
2% |
2% |
|
|
Tween 20 |
2% |
2% |
|
|
Nonidet P40 |
2% |
2% |
|
chelating agents |
EDTA |
not recommended |
50 mM |
|
|
EGTA |
not recommended |
5 mM |
|
metal ions/ligands |
CaCl2 |
5 mM, maximum |
up to 1 M |
|
salts |
Ammonium |
not recommended |
2 M |
|
buffer components |
NaCl |
Up to 2 M, at least 300 mM should be used |
5 M |
|
|
Tris |
not recommended |
possible |
|
|
HEPES |
not recommended |
possible |
|
|
MOPS |
not recommended |
possible |
如果分离纯化膜蛋白或包涵体时,则纯化过程需要涉及到变性条件。
Strep-tag® 系统最多允许的尿素浓度为 6M,盐酸胍为 1M,而 His-tag 则为 8M 和 6M。如若需要增加蛋白的溶解度,使用去垢剂,则两种系统均可兼容 Triton-X100,Tween 20 和 Nonidet P40。
但不是所有的蛋白过表达后都在包涵体内,且膜蛋白仅占细胞表达蛋白的 20%-30%。
因此,如果纯化过程需要考虑特殊的纯化条件,两种系统是都可以选择的。但如果比较其他的常规缓冲液,Strep-tag® 系统则耐受的情况则更理想,其可兼容多种盐溶液,配体,金属离子,以及还原剂和螯合剂。
对比 β-巯基乙醇或氯化钙来说,His-tag 耐受的范围较小。而像 Tris,HEPES 或 MOPS buffer 则不推荐在 His-tag 系统中使用,至于铵,DTT 或 EDTA 则更需避免使用。但 Strep-tag® 系统可耐受以上提及的 buffer 条件,通过配体或金属离子使目的蛋白保持稳定的状态,避免被蛋白酶降解或氧化过程中的损失。
因此 Strep-tag 系统的纯化可以被应用到更多类型蛋白中,如在金属蛋白的纯化。
如果对比两个系统耐受的 pH 值,Strep-tag® 系统则耐受 pH 范围在 4-10,在 pH 敏感蛋白的纯化选择上具有优势。His-tag 系统不应该被使用在低pH 条件的纯化中,在 pH 4.5-6 的情况下,会导致蛋白的洗脱而造成流失。
表达宿主
在生产蛋白质过程中,宿主的选择十分重要,因其不仅影响蛋白的表达,而且也影响随后的纯化过程。除耐受缓冲液条件有限外,当选择宿主表达系统时,His-tag 也有一些局限。
His-tag 大肠杆菌表达系统中较为有利,但实际情况下对于酵母,哺乳动物和昆虫细胞表达系统,尤其是分泌蛋白的纯化中,His-tag 系统则有局限。因为酵母和昆虫细胞的培养基 pH 通常为酸性,会干扰 His-标签蛋白与 IMAC 纯化树脂的结合。而酵母和哺乳动物细胞培养基,则通常含有氨基酸会竞争 His- 标签的结合位点,如组氨酸,谷氨酰胺或精氨酸。
Strep-tag® 系统对各宿主表达系统的适用情况较为理想。根据其纯化原理,酸性 pH 和有力的氨基酸不会影响 Strep- 标签蛋白与纯化树脂的结合(前文也曾提到,此系统的耐受 pH 范围为 4-10)。而哺乳动物细胞培养基中存在的生物素需要注意,但实际上无需过多担心。因为其可通过添加适当封闭液进行封闭,且在 Twin-Strep-tag®: Strep-Tactin® XT 系统中不会产生影响。
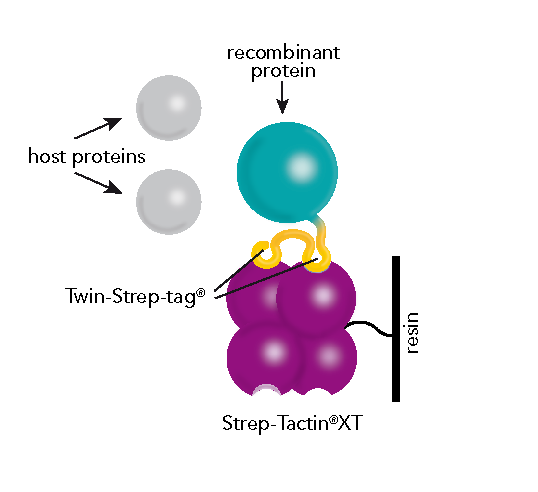
如果考虑使用 His-tag 在酵母,昆虫或哺乳动物细胞中表达蛋白,在成本考量上还需加入后续的实验步骤,根据情况如透析,过滤,尺寸排阻或离子交换色谱等。
因此 His-tag 在量上的优势虽然很明显,但如核算总成本,“多快好省”仍是一种理想。
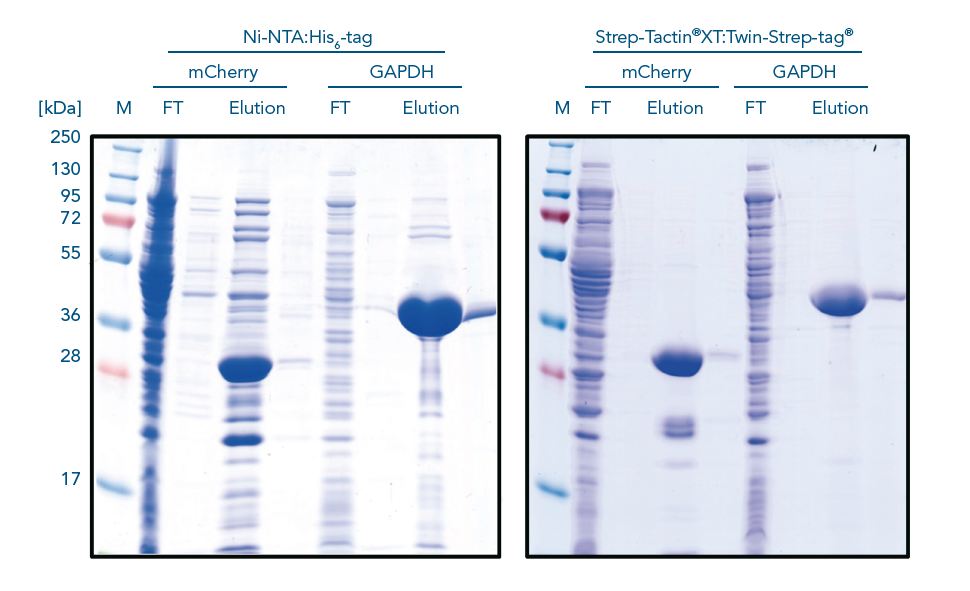
比较第三代 Strep-tag® 系统(右)与 His-tag 系统(左)在 native 条件下,纯化 mCherry 及 GAPDH 蛋白的效果
全面的考虑:质与量的选择
|
reagents |
His-tag system |
Strep-tag® technology |
|
affinity tag |
6 or more consecutive histidine residues |
Strep-tag®II (8AA peptide) or Twin-Strep-tag® (28 AA peptide) |
|
position |
N-terminal |
N-terminal |
|
|
internal |
internal |
|
|
C-terminal |
C-terminal |
|
ligand |
transition metal ions (nickel or cobalt) |
engineered streptavidins: Strep-Tactin® and Strep-Tactin®XT |
|
eluent |
imidazole gradient (0-250 mM) |
desthiobiotin |
|
|
decrease in pH (4.5-6) |
biotin |
|
|
chelation agents (EDTA) |
|
|
re-use of resin |
yes |
yes |
|
good yields with |
E. coli |
E. coli |
|
|
|
yeast |
|
|
|
insect cells |
|
|
|
mammalian cells |
如果在选择纯化系统的选择上仍有疑虑,在下列表格中,全面对比了两种系统的各方面性质,希望可以帮助提供一些参考,如有需要可以收藏:
|
suitable for |
membrane proteins |
all protein classes, including membrane proteins, metalloproteins, pH sensible proteins, oxidation and proteolytic damage sensitive proteins |
|
purity |
~80% |
>95% |
|
yield |
5 to 40 mg/ml resin |
Up to 16 mg/ml resin |
|
native conditions |
yes |
yes |
|
denaturing conditions |
yes |
Up to 6 M urea |
|
detergents |
yes |
yes |
|
chelating agents |
not recommended |
possible |
|
reducing agents |
not recommended |
possible |
|
salts |
with restrictions |
possible |
|
affinity |
µM to nM |
µM to pM |
|
analytic applications |
not recommended for high affini- ty applications, like BLI or SPR |
no limitations |
|
drawback |
interacts nonspecifically with complex-forming amino acids |
interacts with biotinylated proteins, but they can be masked by addition of avidin |
亲和力和特异性,将直接对纯化过程中蛋白挂柱的情况有影响。
His-tag 系统的亲和力仅在 nM - µM 的范围内,会在导致过程中导致蛋白的流失。此外,由于 His-tag 抗体特异性较低,这会导致在使用检测过程中,检测到含有 His 残基的非特异性蛋白。
当进行类似分析等有高亲和力/高特异性抗体需求的实验应用时,如 SPR 或 BLI,Strep-tag® 技术则成为首选,因其 µM-pM 的亲和力范围赋予了较大优势。因此根据需要选择合适的纯化系统非常重要。

此外,由于不同的实验需求,需要多种多样的产品形式。Strep-tag® 系统优点众多,历经长时间的发展,市面上已不仅有纯化填料可以选择,分析类实验的工具也日渐完善。
在各类文献中不难看到的有:标记了荧光染料的 Strep-Tactin® XT 偶联物/抗体,Strep-Tactin® XT 包被板,和适用于 SPR 分析的 win-Strep-tag® Capture Kit。









