从纯化到分析应用
德国 IBA Lifesciences 专利的 Strep-tag® 技术利用自然界中最强的非共价作用之一:生物素(biotin)和链霉亲和素(streptavidin)之间的相互作用。该技术基于合成的 Strep-tag® II 和特殊改造的链霉亲和素—— Strep-Tactin® 和 Strep-Tactin®XT 之间的相互作用。短肽标签 Strep-tag®可以特异性地结合配体上的生物素结合位点,并且通过加入特异性的竞争剂实现此结合的可逆。

Strep 标签纯化系统包含两个标签,两个链霉亲和素变体:8 个氨基酸的 Strep-tag®II(Trp-Ser-His-Pro-Gln-Phe-Glu-Lys)和将其串联而成的 Twin-Strep-tag®(28 个氨基酸)。这两个标签都对链霉亲和素变体 Strep-Tactin®和 Strep-Tactin®XT 表现出内在的亲和力:Strep-tag® II 对 Strep-Tactin® (1µM) 的结合亲和力几乎比对链霉亲和素的结合亲和力高 100 倍。而进一步升级的 Strep-Tactin®XT,与 Strep-tag® II 的亲和力为 nM ,与 Twin-Strep-tag®的亲和力为 pM 。
一种标签 多种应用
可以根据待研究目的蛋白的性质与特点,选择不同亲和力组合的标签和 Strep-Tactin®配体。
Strep 标签能以简便的纯化方法得到高纯度的蛋白,因此受到众多研究人员青睐。最新一代的 Strep-Tactin®XT 与 Twin-Strep-tag® 的结合亲和力达到 pM 范围,却仍可以保持结合可逆性,温和的固定蛋白质。亲和力的提升后,能有效提升纯度与产量,甚至对于具有挑战性的蛋白质和来自哺乳动物表达系统(例如 Expi)的蛋白质也是如此。
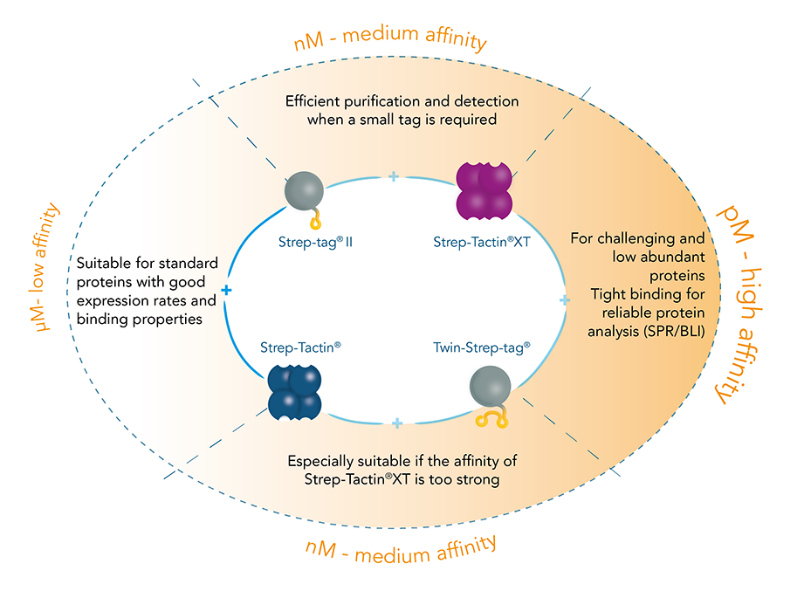
此外,它满足蛋白质相互作用分析测定以及 SPR 等下游高要求的实验应用,有效的覆盖了从纯化到固定分析的所有步骤。
产品形式

不同的标签-配体之间的结合强度存在差异,Strep-tag® 系统可用于分离蛋白质和细胞。
- 使用 Strep-Tactin® 对 Strep 标签蛋白进行高效的纯化。
- 当与抗体衍生的 Fab 片段或纳米抗体融合时,Twin-Strep-tag®会与多聚化的 Strep-Tactin® 结合,从而根据其表面标志或抗原特异性捕获和释放目标细胞。
- Strep-Tactin®(或 Strep-Tactin®XT)可以与微孔板、荧光团或芯片结合,在分离目标材料后可以进行广泛的分析应用,例如检测、固定和相互作用研究。
技术特点
- 高达pM 范围的亲和力(KD up to 6.2 x 10-11 M)
- 纯化树脂材质稳定
- 小标签(8~28 aa)无需移除,不影响蛋白折叠和功能
- 极高的蛋白纯度(纯度> 95%)
- 应用于多种目标蛋白检测系统:Western blot,ELISA,免疫荧光,FACS等
- 兼容多种缓冲条件:高盐,洗涤剂,金属离子,螯合剂,还原剂
- 适用于多种蛋白的纯化,如膜蛋白、金属蛋白,低丰度蛋白等
- Twin-Strep-tag®标签蛋白固定在界面上时(SPR,BLI)蛋白不易脱落
配体介绍
Strep-Tactin®和 Strep-Tactin® XT 均是优化过的链霉亲和素,为四聚体形式。每个单体的分子量为 13 kDa。总分子量为 52 kDa。每个单体都包含一个生物素结合口袋。链霉亲和素以几乎不可逆的亲和力结合生物素,而 Strep-Tactin® 和 Strep-Tactin®XT 对生物素的亲和力相对降低,且仍然保留了结合生物素的能力。
Strep-Tactin® 和 Strep-Tactin® XT上的生物素结合口袋已针对结合 Strep-tag®标签 及 Twin-Strep-tag® 标签进行了优化。标签 Twin-Strep-tag® 和配体 Strep-Tactin® XT 的结合亲和力高达 pM,非常适合于在 ELISA 或 SPR 等分析应用中对蛋白质进行固定和检测(详见Schmidt et al. 2021)。
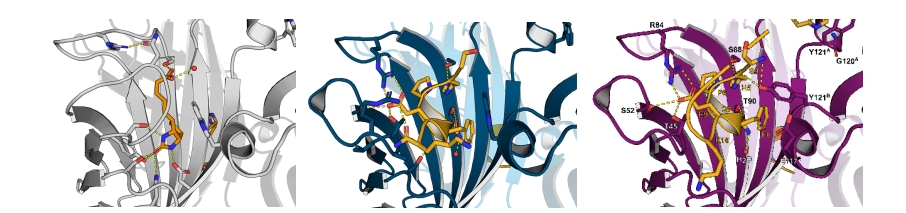 Streptavidin & biotin Strep-Tactin®与 Strep-tag® Strep-Tactin® XT 与 Twin-Strep-tag®
Streptavidin & biotin Strep-Tactin®与 Strep-tag® Strep-Tactin® XT 与 Twin-Strep-tag®
蛋白质纯化:Strep-tag® 技术原理








